抗体:结构与纯化挑战
抗体(Antibody)是机体针对抗原刺激产生的特异性免疫球蛋白(Ig),是体液免疫反应的重要效应分子。抗体主要由两条重链(heavy chain,H)和两条轻链(light chain,L)组成(见Fig.1)。根据重链恒定区氨基酸组成和排列顺序的不同,分为IgM、IgD、IgG、IgA 和IgE五类,其中IgG是治疗性抗体中最常见的形式。
同一类的Ig,根据其铰链区氨基酸组成和重链二硫键的数量及位置的不同,又分为不同的亚类(subclass),如人IgG可分为四个亚类,包括IgG1、IgG2、IgG3和IgG4。轻链可分为两种,分别为kappa(κ)链和lambda(λ)链。据此,可将Ig分为两型(type),即κ型和λ型。
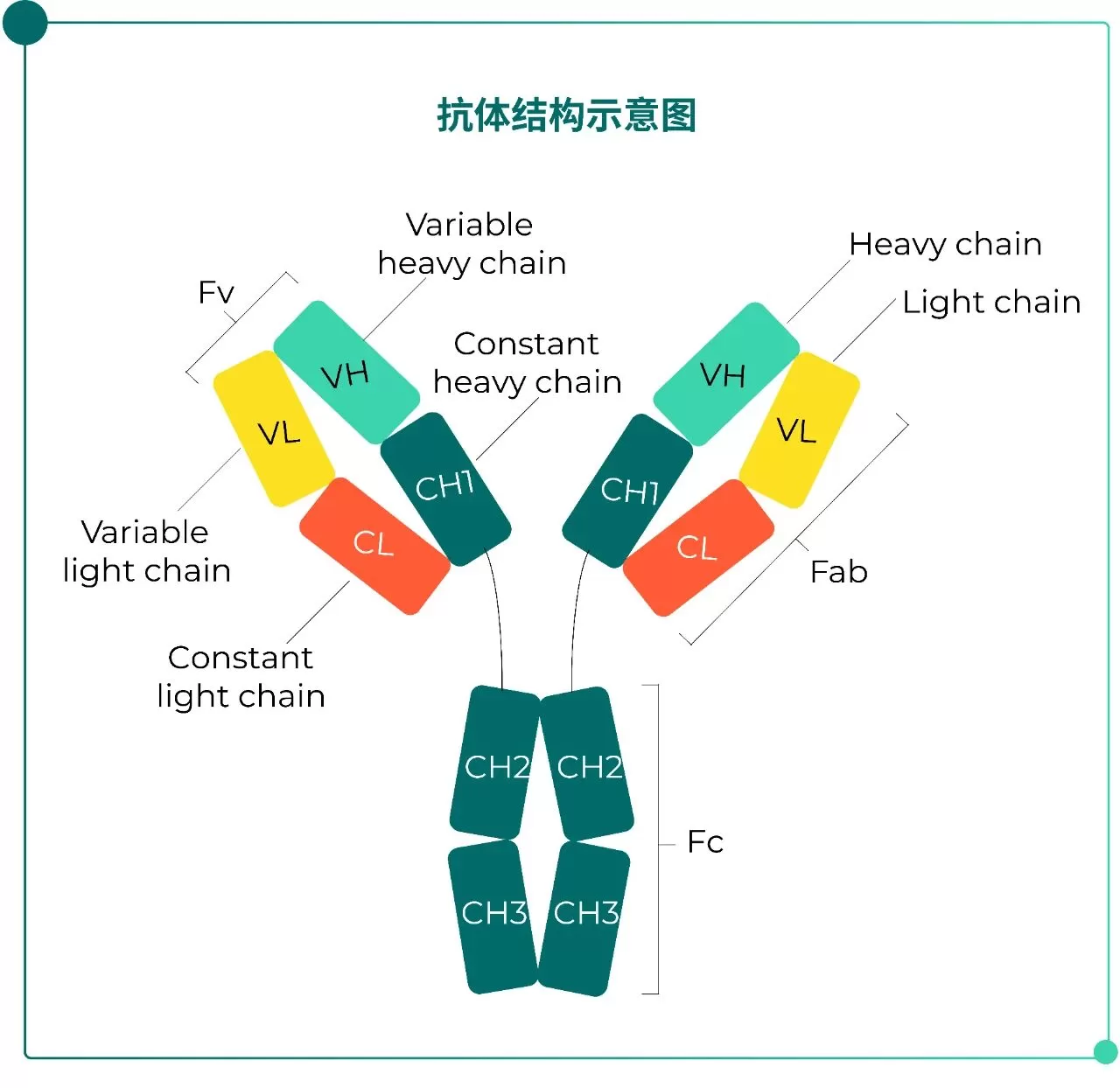
Fig.1 抗体结构示意图
随着抗体药物技术的不断演进,抗体类型与分子结构日趋多样化。
从传统单抗(mAb)到双抗(BsAb)、抗体偶联药物(ADC)、抗体寡核苷酸偶联体(AOC)及多价抗体等新分子形式层出不穷。
这些分子在 Fc 结构、亲和力、糖基化修饰及热稳定性 等方面存在显著差异,
导致下游纯化环节面临新的挑战:
• Protein A 结合差异增大:部分抗体或片段无法稳定结合;
• 分子稳定性更敏感:低 pH 洗脱易引发构象变化或聚集;
• 杂质性质更接近:片段、聚集体及错配体在电荷、疏水性上与主峰相似,分离难度显著增加;
• 工艺窗口更窄:对配基选择、洗脱条件及清洗策略提出更高要求。
因此,开发兼顾高选择性、温和洗脱条件的亲和层析工艺,成为抗体纯化工艺优化的关键方向。
抗体亲和层析的原理
抗体亲和层析(Antibody Affinity Chromatography)是利用生物分子间特异性相互作用实现高选择性分离的经典方法。
最常用的配基为 Protein A——源自金黄色葡萄球菌的膜蛋白,可与抗体 Fc 区特异性结合,实现一步捕获与高纯化。
天然 Protein A 含五个 IgG 结合域,但也具有非特异结合片段,现代填料多采用基因改造型 Protein A,保留 Fc 结合功能的同时,显著降低非特异吸附并增强其耐碱性。
此外,对于 Fab、IgM、抗体片段 等特殊分子,还可使用 Protein L(结合 κ 链)或 IgM 亲和填料 进行特异分离。
核心原理:利用抗体与配基的高亲和结合 → 非目标杂质洗脱 → 调整 pH 实现可逆洗脱。
亲和填料选择的关键要素
选择合适的亲和填料,是抗体纯化工艺开发与产业化放大的核心环节。
优秀的填料不仅要具备良好的分离性能,还需兼顾放大可行性、长期稳定性与供应可靠性。
1.配基类型与结合特异性
不同亲和配基识别的抗体结构位点不同,合适配基的选择是实现高选择性捕获的基础。
• Protein A:与抗体的 Fc 区结合,适用于 IgG1、IgG2、IgG4 及多数 Fc 融合蛋白,是当前最主流的抗体捕获配基;
• Protein L:识别 κ 轻链区域,适用于无 Fc 结构的抗体片段(如 Fab、scFv)或Fc改造后的抗体及部分 IgA、IgM;
• Protein G:结合范围更广,可作为 Protein A 的补充,用于特殊亚型或部分Fab的结合;
• IgM :识别多聚结构域,能在高分子量条件下保持高选择性分离。
不同抗体类型(IgG、IgM、IgA、双抗、抗体片段等)需根据结合结构、亚型及分子特性匹配合适配基,才能获得最佳纯度与回收率。
下图展示了抗体亲和填料选择流程图(Fig.2),可帮助研发人员在早期开发阶段快速判断适用填料类型与推荐产品:
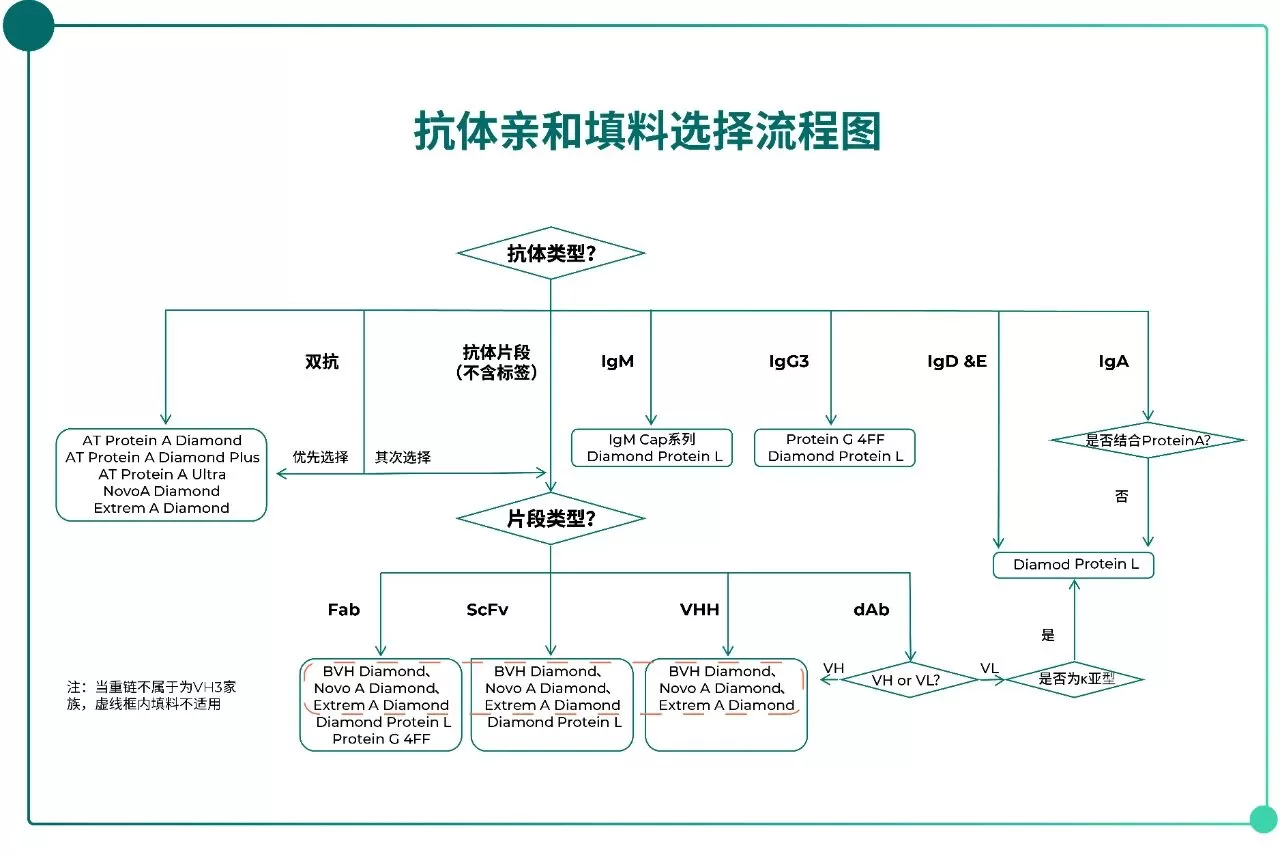
Fig.2 抗体亲和填料选择流程图
2.动态结合载量(DBC)与分离平衡
DBC(Dynamic Binding Capacity)反映填料在特定流速与保留时间下的结合能力,是评价抗体捕获效率的重要指标。
• DBC 高 → 捕获通量提升、处理能力强,但可能导致分辨率下降或杂质共洗脱;
• DBC 低 → 分离效果好但通量不足。
工艺开发中需在载量、流速、收率与纯度之间找到平衡点,综合考虑分离效率与工艺的经济性。
3.可放大性与压力–流速性能
可放大性是衡量填料从实验室到生产规模平稳过渡能力的关键。
部分填料在小试阶段表现良好,但放大后因机械强度不足或柱床压缩,出现运行压力上升、流速受限、柱床塌陷等问题,迫使客户在中后期调整工艺或降低生产效率。
建议在早期开发阶段就验证填料的压力–流速表现与可用线速度窗口,确保放大后依然满足通量与运行压力要求。
4.长期耐碱稳定性
亲和层析需经受反复NaOH在位清洗(CIP),耐碱性能直接决定填料使用寿命与生产成本。
高耐碱性填料可承受 0.5–1.0 M NaOH 清洗数百循环而保持载量与性能稳定,是实现长期稳定生产的关键。
5.批间一致性与供应稳定性
在工业化阶段,层析填料不仅是纯化工艺的关键耗材,更是保证生产稳定、可控的重要组成部分。
填料的质量批间一致性和稳定供应直接影响工艺的稳健运行与用户终产品质量的一致性。
• 批间一致性:考察不同批次填料在关键性能等方面保持稳定,以确保纯化工艺在不同生产周期中具备良好的重复性和产品质量一致性。若批次差异过大,可能导致目标蛋白回收率波动、杂质谱变化或放大验证失败。
• 供应稳定性:考察方向应不仅包含供应商持续、可靠的供货能力,还应包括供应商在质量管理体系、生产产能、工艺一致性验证及技术支持等方面的长期稳定性。对于商业化生产企业而言,供应链的稳定与可持续性是维持生产稳定运行和风险可控的前提条件。
在亲和填料筛选阶段,应将产品的批间一致性与供应商的长期稳定供货能力纳入综合考量。
这不仅关系到物料性能的可重复性,也决定了工艺的稳健性和最终产品的质量稳定性。
应用案例:Novo-A Diamond 的温和洗脱表现
在抗体纯化中,低 pH 洗脱可能引起抗体构象变化和聚集。
使用 Novo-A Diamond 在 pH 4.0 条件下即可完全洗脱,纯度 >94%,回收率 >95%,载量约 65 mg/mL(Fig.3)。
实验条件:
层析柱:EzScreen 4.4 mL(Bed height = 10 cm)
样品:mAb 原样,样品浓度6.8 mg/mL
Binding buffer: 20mM Tris-HCl, 0.15M NaCl, pH 7.2
Wash buffer 1: 20mM NaAc,1 M NaCl, pH 7.2
Wash buffer 2: 20mM Tris-HCl, pH 7.2
Elution buffer 1: 50mM NaAc-HAc, pH 4.0
Elution buffer 2: 50mM NaAc-HAc, pH 3.5
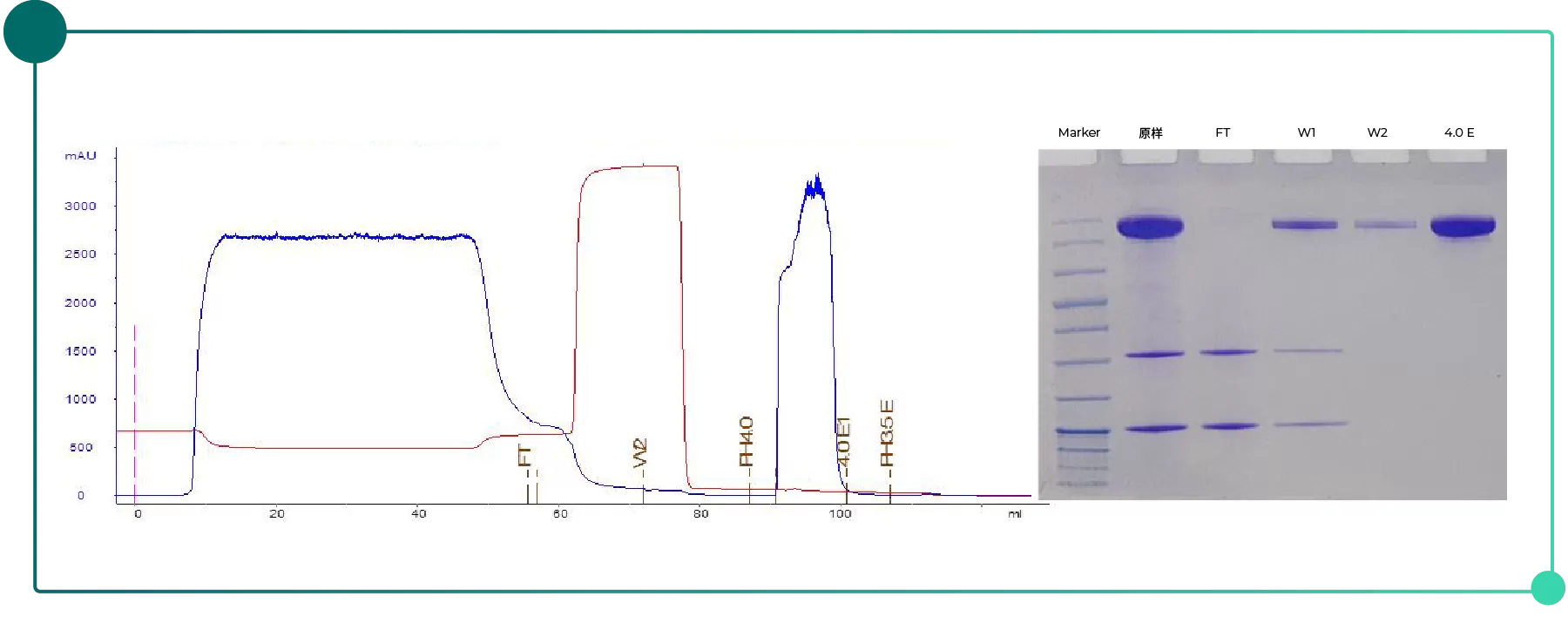
Fig.3 Novo-A Diamond单抗纯化层析及电泳图谱
结果表明:Novo-A Diamond 在温和洗脱条件下仍具高捕获能力,适合对低pH条件敏感抗体的纯化。
总结
抗体亲和层析是单抗及其衍生分子下游纯化的关键环节,理想的亲和填料应在 分离性能(DBC 与纯度)、放大适配性(压力–流速与耐碱性) 及供应保障(批间一致性与供应商能力)之间实现平衡。
在早期工艺开发阶段充分评估这些维度,可有效避免后期因流速受限、配基衰减或供货波动引起的工艺变更与验证风险。
订购与试用申请
| 产品名称 | 规格 | 货号 |
| AT Protein A Diamond Plus | 25mL | AA402305 |
| AT Protein A Diamond Ultra | 25mL | AA05701 |
| Novo-A Diamond | 25mL | AA05001 |
| Extrem A Diamond | 25mL | AA04501 |
| Diamond Protein L | 25mL | AA05101 |
更多产品请至博格隆官方网站(www.bestchrom.cn)查询。
产品快速订购通道:请拨打热线电话:400-820-5172
或发送邮件至客服邮箱:info@bestchrom.com
